ICP is more than a number
Erhöhte intrakranielle Drücke können über die Reduktion des zerebralen Blutflusses zu einer Minderversorgung des Gehirns und Ischämie bis hin zum Absterben von Nerven- und Gehirnzellen führen. Darüber hinaus kann es zu einer gefährlichen Verlagerung von Hirngewebe im Schädel kommen, z.B. der Verschiebung von Teilen des Kleinhirns in Richtung Foramen magnum. Man spricht hierbei von Herniation.
Die Ziele der therapeutischen Senkung erhöhter intrakranieller Drücke liegen somit u. a. in der Wiederherstellung bzw. Aufrechterhaltung der Blutversorgung des Gehirns und der Verhinderung der Verlagerung von Hirngewebe. Darüber hinaus sollen ebenfalls das Wohlbefinden des Patienten verbessert sowie Symptome wie Kopfschmerzen und Übelkeit reduziert und im Idealfall beseitigt werden.
In der Vergangenheit lag der Fokus dabei darauf, den ICP unterhalb eines definierten Grenzwerts zu senken. Die diagnostische Grundlage hierfür bieten invasive Drucksensoren, mit denen der intrakranielle Druck, z.B. auf der Neurointensivstation bestimmt werden kann. Diese Geräte verfügen hierfür u.a. über die Anzeige des gemessenen mittleren ICP.
Es zeigte sich jedoch insbesondere in den letzten Jahren, dass die reine Betrachtung eines ICP-Grenzwerts für eine effektive Behandlung der Patienten nicht ausreicht (Carrera, Kim, Castellani, 20107). Dies hat mehrere Ursachen: Durch die Reduktion auf eine einzelne Zahl gehen sehr viele wertvolle Informationen über die zerebrospinalen Regulationsprozesse verloren. Ein derartiger Grenzwert stellt eine zu starke Vereinfachung der sehr komplexen und heterogenen Krankheitsbilder dar (Le Roux, 20168). Darüber hinaus werden Grenzwerte typischerweise in Studien mit einer großen Anzahl von Teilnehmern ermittelt, so dass die Individualität des einzelnen Patienten in den Hintergrund tritt. Entsprechende Grenzwerte bieten im Allgemeinen auch nur die Möglichkeit, reaktiv auf das Überschreiten des vorgegebenen intrakraniellen Drucks zu reagieren (Le Roux, 20169).
Zur weiteren Erläuterung werden nachfolgend beispielhaft zwei Patienten verglichen, deren intrakranielle Drücke zum Zeitpunkt der Messung oberhalb des physiologischen, d.h. des gesunden Bereichs liegen: Patient A verfügt über eine hohe Compliance (Le Roux, 201610) , d.h. kleine Veränderungen der intrakraniellen Gegebenheiten führen zu keiner signifikanten Veränderung des ICP. Die erhöhten Druckwerte könnten für diesen Patienten gut tolerabel sein. Patient B hingegen zeigt eine reduzierte Compliance. Bei ihm führen bereits kleine pathologische Volumenzunahmen zu starken ICP-Erhöhungen und kritischen Reaktionen. Beide Patienten müssen bei steigendem ICP therapeutisch unterschiedlich betreut werden, die Fokussierung auf einen ICP-Grenzwert reicht in diesen Fällen nicht aus. Bei der individuellen Behandlung der beiden Patienten und Abwägung zwischen verschiedenen Therapieoptionen müssen somit weitere Kenngrößen, wie z.B. die Compliance berücksichtigt werden. Doch wie können diese Parameter ermittelt werden?
Durch Fortschritte in der Messtechnik und Datenverarbeitung ist es inzwischen möglich, größere Datensätze in Echtzeit (d.h. schon während sie gemessen werden) auszuwerten. Hierdurch stehen dem behandelnden Arzt neue Informationen zur Verfügung, die ohne technische Unterstützung in der Vergangenheit nicht zugänglich waren. Im Bereich der intrakraniellen Drucksensorik rückt hierdurch immer stärker die Analyse des Zeitverlaufs der ICP-Kurven in den Vordergrund. Es konnte gezeigt werden, dass die Dynamik des ICP, dessen Wellenform und die daraus abgeleiteten Kenngrößen nützliche Informationen bieten, um die Behandlung von Patienten auf ein qualitativ höheres Niveau zu heben sowie proaktiv kritischen Trends entgegenzuwirken (Le Roux, 201611) (Czosnyka, Smielewski, 200712).
Compliance
Nachfolgend wird der oben verwendete Begriff Compliance im Detail erklärt. Anschaulich gesprochen reflektiert die Compliance etwas wie die „Weichheit“ oder „Elastizität“ des gesamten Schädel- und Spinalraumes. Sie charakterisiert somit nicht nur das Gehirn, sondern das gesamte Zentrale Nervensystem (ZNS), d.h. den Schädelinnenraum und den Rückenmarkskanal. Diese Elastizität ist eine „Pseudo-Elastizität“, denn die Bestandteile Hirngewebe/Rückenmark, Blut und CSF sind für sich genommen inkompressibel, oder anders gesagt, „hart“. Die Compliance kommt so zustande, dass bei jedem zusätzlichen Volumen („Raumforderung“) innerhalb des harten Schädelvolumens – z.B. durch einen Aufstau von zu viel CSF (Hydrocephalus), bei einer Blutung (Hämatom) oder durch eine Geschwulst (Krebs, Zyste, Schwellung) – im Wesentlichen venöses Blut aus dem starren Raum nach außen in den Körper verdrängt wird. So steigt der intrakranielle Druck durch solche Raumforderungen bei normaler Compliance zunächst nur wenig an, weshalb diese auch oft mit einer „Druck-Reserve-Kapazität“ assoziiert wird. Wird die Raumforderung jedoch zu groß, so ist auch diese Reservekapazität bald erschöpft und der ICP steigt stark an. Eine Minderung der Compliance ergibt sich aber nicht nur durch eine zu hohe Raumforderung, sondern auch durch pathologische Verhärtung des Gewebes und der Gefäße, vor allem der Venen (Sklerose). Die Bestimmung der Compliance hat einen „diagnostischen Wert“, denn man erfährt durch sie etwas über das Außmaß der Raumforderung und den Zustand des Gewebes bzw. der Blutgefäße
Die exakte medizinische Definition der Compliance als Druck-Volumen-Beziehung (C = dV/dP) ist in der folgenden ICP-Volumen-Kurve erläutert:

D.h. Compliance entspricht dem inversen Anstieg an einem betrachteten Punkt der patientenindividuellen ICP-Volumen-Kurve.
Zwar befinden sich nur wenige Prozent der gesamten CSF-Menge im knöchernen Spinalkanal, dafür aber umso mehr venöses Blut (d.h. Venen). Der „durale Sack“, in dem sich das spinale CSF befindet, ist dehnbar und weitet sich im Stehen durch das Absacken von CSF aus dem Schädel nach unten deutlich auf. Insgesamt trägt der Spinalkanal wahrscheinlich zu mehr als 50% zur gesamten Compliance bei.
Intrakranielle Druckkurven – ein Crash-Kurs
Die ICP-Wellenform kann primär drei Komponenten aufweisen (Czosnyka, Smielewski, 200713):
- pulsatiler Anteil, der mit dem Herzschlag assoziiert ist (typische Herzfrequenz 50-180 Schläge/min)
- respiratorischer Anteil, der mit der Atmung assoziiert ist (typische Atemfrequenz von 8-20 Zyklen/Minute)
- langsamer vasogener Anteil, d.h. der von den Blutgefäßen ausgehende Anteil;
beispielsweise können die sog. Lundberg A- und B-Wellen im Drucksignal beobachtet werden (typisch 0,3-3 Zyklen/Minute) (Czosnyka, Smielewski, 200711)
Im Zeitverlauf einer ICP-Kurve ergibt sich beispielhaft folgendes Bild (Czosnyka, Smielewski, 200715):
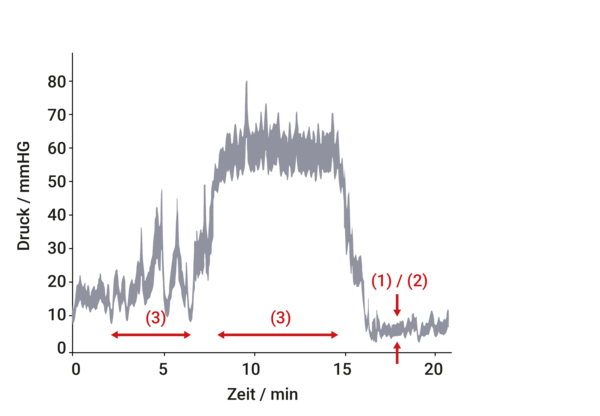
Die pulsatilen (1) und respiratorischen (2) Anteile zeigen verglichen zu den vasogenen (3) Lundberg A und B Wellen bedeutend kleinere Amplituden.
Pulsatiler Anteil
Der Diagnostische Wert von Pulsamplituden
Als quantitatives Maß für die Intensität der Druckpulse werden in der Diagnostik die sog. Pulsamplituden (AMP) bestimmt. Diese entsprechen der Druckdifferenz zwischen dem Maximum und den benachbarten beiden Minima eines jeden Pulses. In der Literatur werden die Pulsamplituden auch als Mean ICP wave amplitude (MWA) bezeichnet.

Die Pulsamplituden (AMP) sind von physiologischen und pathologischen Gegebenheiten im intrakraniellen und spinalen Raum abhängig. Die Zusammenhänge können anhand der ICP-Volumen-Kurve beschrieben werden.
Im Fall hoher Compliance (auf der linken Seite des Kurvenverlaufs mit geringem Anstiegs in der ICP-Volumen-Kurve) führen die pulsierenden Volumenänderungen zu vernachlässigbaren Druckpulsen, die zugehörigen Pulsamplituden sind klein. Bei reduzierter Compliance (z.B. bei Auftreten eines Tumors) werden jedoch große Pulsamplituden beobachtet. Die Compliance spiegelt also so etwas wie die „Reservekapazität“ des Gehirns wider und sagt etwas darüber aus, inwieweit intrakranielle Volumenzunahmen den ICP sofort stark ansteigen lassen oder ob ein Verschieben von Blut und CSF aus dem intrakraniellen Raum diesen Effekt kompensieren kann. Bei sehr hohen ICP-Werten flacht die Kurve wieder ab.
Abbildung nach (Czosnyka, Pickard, 200416)
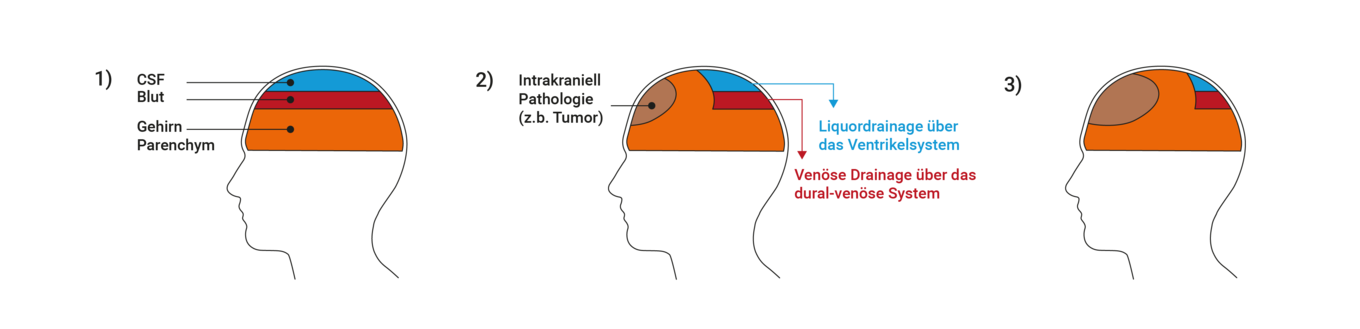
Abbildung nach (TeachMeSurgery, 202017)
Durch diesen Zusammenhang ist es möglich, über die Quantifizierung der Pulsamplituden Aussagen über die Compliance zu erhalten. Es ist bekannt, dass beispielsweise Amplituden größer als 4 mmHG auf pathologische Veränderungen mit reduzierter Compliance hindeuten können (Eide, 201618).
Messtechnisch können die Pulsamplituden direkt in der ICP-Kurve abgelesen werden. Die ermittelten Messwerte sind dabei unabhängig von möglichen Drifteffekten der Drucksensorik.
Voraussetzung für die Bestimmung der Pulsamplituden: Das Messsystem muss u.a. über eine ausreichend hohe Abtastrate verfügen, um diese Werte ausreichend genau bestimmen zu können. Darüber hinaus ist eine gute Software notwendig, welche die ICP-Wellenform objektiv und automatisch analysieren kann (Pennacchietti, 202019).
Der diagnostische Wert des Korrelationskoeffizienten RAP
– oder einfach ausgedrückt:
Die ICP-Volumen-Kurve zeigt in der Detailanalyse einen ausgeprägten exponentiellen Anstieg. Bei einem bestimmten intrakraniellen Druck wird jedoch ein Wendepunkt der Kurve beobachtet, ab dem sich der Graph mit steigendem ICP wieder abflacht. Dem entsprechend steigen die Pulsamplituden bei steigendem ICP bis zum Wendepunkt an, danach sinken sie wieder. Somit können kleine Pulsamplituden links (bei niedrigem ICP, hohe Compliance) sowie rechts vom Wendepunkt (bei hohem ICP, niedrige Compliance) beobachtet werden. Der ICP und die Pulsamplitude ermöglichen zusammen genommen somit keine eindeutige Beschreibung, auf welchem Teil der ICP-Volumen-Kurve sich der intrakranielle Zustand des Patienten befindet.
Um patientenindividuell eine klare Aussage über die Compliance und kompensatorische Reserve zu ermöglichen, wurde neben den o.g. Parametern eine weitere Kenngröße – der RAP-Index – eingeführt. Der RAP-Index beschreibt den statistischen Zusammenhang zwischen mittlerem ICP und AMP. Das R in der Bezeichnung RAP steht für Korrelationskoeffizient, mit A wird Amplitude abgekürzt und mit P wird der mittlere Druck gekennzeichnet. Der RAP-Index kann Werte von -1 bis +1 annehmen (Czosnyka , Smielewski, Timofeev, 200720).
Welche generellen Aussagen können mit einem Korrelationskoeffizienten getroffen werden? Der Korrelationskoeffizient beschreibt allgemein die Abhängigkeit der Variablen A von der Variablen B:
Beispiel 1: Die Werte der Variablen A nehmen zu, gleichzeitig nehmen die Werte der Variablen B linear zu. Der Korrelationskoeffizient der beiden Variablen beträgt in diesem Fall +1, man spricht hier von positiver linearer Beziehung.
Beispiel 2: Die Werte der Variablen A nehmen zu, gleichzeitig nehmen die Werte der Variablen B linear ab. Der Korrelationskoeffizient nimmt hier den Wert -1 an, hier liegt eine negative lineare Beziehung der beiden Variablen vor.
Ein Korrelationskoeffizient von 0 deutet hingegen auf keine Korrelation hin, d.h. Änderungen der Variablen A führen zu keiner Änderung der Variablen B. Werte zwischen 0 und 1 bzw. 0 und -1 deuten auf eine Korrelation der beiden Variablen hin, die jedoch nicht vollständig linear ist (Ratner, 200921).
Übertragen auf den RAP-Index können folgende Aussagen getroffen werden: Bei kleinen intrakraniellen Druckwerten führen kleine Volumenänderungen auf dem linken Teil der ICP-Volumen-Kurve zu keiner Erhöhung der Pulsamplituden. Durch die fehlende Korrelation dieser beiden Werte ist der RAP-Index gleich 0.

Bei höheren intrakraniellen Druckwerten nimmt der RAP-Index im Bereich des steilen Anstiegs der ICP-Volumen-Kurve den Wert >0 an, d.h. der Anstieg des ICP führt zu einer Erhöhung der Pulsamplituden. In diesem Bereich ist die Kompensationsreserve gering, so dass kleine Volumenänderungen zu einem starken Anstieg des ICP führen. Bei der weiteren Erhöhung des ICP nimmt ab dem Wendepunkt der ICP-Volumen-Kurve die Pulsamplitude wieder ab. Hierbei ist der RAP-Index <0. Am Wendepunkt wechselt somit RAP das Vorzeichen. Dies kennzeichnet einen kritischen Bereich, ab dem erhöhte ICP-Werte zu einer zu Ischämie, irreversibler Hirnschädigung und Herniation führen können (Jin, Choi, Kim,201922). Schlussendlich werden bei stark erhöhten Druckwerten keine Pulsationen mehr im Drucksignal beobachtet, der RAP-Index nimmt wieder den Wert 0 an.
Aus praktischer Sicht hat der RAP-Index z.B. im Bereich der Neurointensivmedizin Relevanz. Bei den meisten Patienten, die wegen eines Schädel-Hirn-Traumas ins Krankenhaus eingeliefert werden, wird über die ersten Stunden eine gute kompensatorische Reserve beobachtet (RAP ist 0), die sich jedoch beim Auftreten eines Hirnödems verschlechtert. Der RAP weist dann durchgehend Werte nahe +1 auf (Czosnyka, Smielewski, Timofeev, et al., 200723).
Eine Reduktion bzw. Erhöhung des RAP-Index kann zum einen mit der Veränderung der Position des patientenindividuellen kraniospinalen Systems auf der ICP-Volumen-Kurve zusammenhängen. Zum anderen könnten z.B. auch pathologische Effekte dazu führen, dass sich die Form dieser Kurve mit der Zeit verändert und ein veränderter RAP-Index ermittelt wird.
Zusammenfassend kann festgehalten werden, dass sich der RAP-Index als zuverlässiges Maß für die kompensatorische Reserve (Czosnyka, Steiner, Balestreri, et al., 200524) und die Compliance (Varsos, Kasprowicz, Smielewski, Czosnyka, 201425) erwiesen hat.
Voraussetzung für die Bestimmung des RAP-Index: Das Druckmesssystem muss u.a. eine geringe Drift und hohe Genauigkeit bei gleichzeitig angemessener Abtastrate des Drucksignals aufweisen, um auf Basis des ermittelten mittleren ICP und der Pulsamplituden den RAP berechnen zu können.
Der Diagnostische Wert der Feinstruktur der Druckpulse
Bei der Detailanalyse des zeitlichen Verlaufs des pulsatilen Anteils wird eine charakteristische Feinstruktur sichtbar. Es zeigt sich, dass jeder Druckpuls aus zumindest drei Einzelpulsen zusammengesetzt ist. Diese werden auf der Zeitachse fortlaufend von links nach rechts mit P1, P2 und P3 gekennzeichnet. Welchen Ursprung haben sie und kann man diese für eine Diagnose verwenden?
Die P1-Welle, die auch als „Percussion Wave“ bezeichnet wird, ist ein Resultat des arteriellen Pulses, der sich auf den intrakraniellen Raum ausbreitet. P1 ergibt sich aus der unmittelbaren Aufdehnung der Arterienwände aufgrund des Pulses (sog. Windkesseleffekt), die sich auf CSF und andere intrakranielle Komponenten überträgt und somit im Drucksignal identifiziert werden kann (Czosnyka, Czosnyka, 202026).
Stellt man die Zeitverläufe des arteriellen Blutdrucks und des ICP gegenüber, dann können weitere Komponenten im intrakraniellen Drucksignal identifiziert werden. P3, benannt als „dikrotische Welle“, sie ist vermutlich venösen Ursprungs.

Abbildung nach (March, Hickey, 201627) und (Czosnyka, Czosnyka, 202028)
Für P2 kann jedoch keine direkte Zuordnung zu einem Kurventeil im arteriellen Druckverlauf gefunden werden. Untersuchungen zeigen, dass P2 möglicherweise mit dem pulsatilen arteriellen intrakraniellen Blutvolumen verknüpft ist (Czosnyka, Czosnyka, 202029). Diese pulsatilen Volumenerhöhungen rufen im Schädel als Antwort pulsatile Druckänderungen hervor (vgl. Kapitel „Der Diagnostische Wert von Pulsamplituden“). Die Amplitude von P2 ist somit anhängig von den elastischen Eigenschaften des intrakraniellen Raums und somit von der Compliance.

Abbildung nach (Stettin, 200830)
Ist die Compliance hoch, dann wird der arterielle Puls vom intrakraniellen Raum abgefedert, die Intensität der Pulse beträgt P1 > P2 > P3 (vgl. Punkt (1) im Kurvenverlauf). Hierbei kann man sich den intrakraniellen Raum mit einer hohen Compliance als Schwamm vorstellen, welche die Pulsationen dämpft. Bei reduzierter intrakranieller Compliance führt eine stärkere Weiterleitung des Pulses durch intrakranielle Komponenten zu einer Erhöhung der Intensität von P2, so dass es zu einer Verschiebung der Intensitäten kommt: P1< P2 > P3 (vgl. Punkte (2) und (3) im Kurvenverlauf). In diesem Fall verhält sich der intrakranielle Raum bzgl. der elastischen Eigenschaften wie ein Stein, der eine geringe Compliance aufweist. Die Feinstruktur der einzelnen Druckpulse ist somit von der Compliance abhängig.
Zusammenfassend kann man sagen, dass neben der Pulsamplitude AMP auch die Feinstruktur der einzelnen Druckpulse diagnostische Informationen über die Compliance enthält.
Voraussetzung für die Bestimmung der Feinstruktur: Das eingesetzte Druckmesssystem muss u.a. über eine ausreichend hohe Abtastrate verfügen, um die Intensitäten der drei Komponenten der einzelnen Druckpulse bestimmen zu können.
Respiratorischer Anteil
Neben dem pulsatilen Anteil können in der ICP-Kurve auch Morphologien beobachtet werden, die der Atmung zugeordnet werden können. Folgende Effekte liegen hier zu Grunde: Während der Einatmung kommt es zu einem Abfall des intrathorakalen Drucks, der zu in einer Reduktion des venösen intrakraniellen Drucks führt. Der Abfluss des Bluts wird gesteigert und der ICP fällt. Durch das entgegengesetzte Verhalten beim Ausatmen zeigt sich im ICP-Verlauf ein sinusförmiges Muster entsprechend der Atemfrequenz. Ein Anstieg des intrathorakalen Drucks und somit Anstieg des ICP kann beispielsweise auch bei dem Vasalvamanöver (z.B. beim Stuhlgang) sowie beim Husten, Niesen und Erbrechen beobachtet werden (Peate, Wild, Nair, 201831).
Beispiel aus der klinischen Praxis
Wie oben beschrieben, können sich in intrakraniellen Druckkurven pulsatile und respiratorische Komponenten wie folgt überlagern:

Aus dem Zeitverlauf der ICP-Kurven können wichtige Kenngrößen abgeleitet werden. Gemittelt über die Zeit kann der mittlere ICP (hier ca.5 mmHg) bestimmt werden. Der Mittelwert ist in der Abbildung mit Blau gekennzeichnet. Die Peaks der pulsatilen Komponente weisen einen Abstand von ca. 0,7 s auf (lila Markierung), d.h. die zugehörige Kontraktion des Herzens erfolgt mit einer Frequenz von 85/min. Die Pulsamplitude der pulsatilen Komponente ist in dem Beispiel mit ca. 5 mmHg hoch, was ggf. auf eine reduzierte Compliance hindeutet (rote Markierung).
Die Peaks der respiratorischen Komponente weisen einen Abstand von ca. 7 s auf, d.h. die zugrundeliegende Atmung erfolgt mit einer Frequenz von ca. 9 Atemzügen/min (grüne Markierung). Die beobachteten Amplituden der respiratorischen Komponente sind in dem betrachteten Beispiel bedeutend kleiner als die des pulsatilen Anteils.
Langsamer vasogener Anteil
Bei ICP-Messungen können neben den höher frequenten pulsatilen und respiratorischen Komponenten auch langsamere Veränderungen des ICP-Signals beobachtet werden. Hierbei handelt es sich um Morphologien, die vasogenen (vasogen - von den Blutgefäßen ausgehend) Ursprungs sind.
Nach Lundberg lassen sich drei Wellenformen A, B und C identifizieren (Lundberg, 196032). Nachfolgend werden die wichtigsten Charakteristika der Lundberg A und B Wellen beschrieben. Wegen der unklaren klinischen Relevanz wird nachfolgend auf Erklärungen der Lundberg C Wellen verzichtet.
Lundberg A-Wellen
Die Lundberg A Wellen werden auch als Plateauwellen bezeichnet. Sie weisen folgende Form auf: Beginnend bei einem bestimmten ICP kommt es zu einem steilen Anstieg des ICP gefolgt von einem Plateau, dass zwischen 5 bis 20 Minuten andauert und Drücke über 50 mmHg erreicht werden. Nach dieser Zeit zeigen die Druckwerte einen steilen Abfall.

Die folgenden Effekte liegen den Lundberg A Wellen zugrunde: Die typischerweise anfänglichen erhöhten ICP-Werte führen zu einer Reduktion des zerebralen Perfusionsdrucks (CPP). Dabei handelt es sich um ein Maß für die Durchblutung des Gehirns. Der CPP stellt dabei die Differenz zwischen arteriellem Mitteldruck (MAP) und ICP dar.

Wenn der zerebrale Perfusionsdruck nicht mehr ausreicht, um den Stoffwechselbedarf im intrakraniellen Raum zu decken, führt das im Rahmen der sog. Autoregulation zu einer zerebralen arteriellen Vasodilatation, also einer Weitung der Blutgefäße. Hierdurch wird das zerebrale Blutvolumen erhöht, das wiederum zu einem noch weiter erhöhten ICP führt. Der wiederholte Kreislauf führt zu lebensbedrohlichen ICP-Werten. Lundberg A-Wellen sind pathologisch und erfordern eine sofortige Therapie.
Lundberg B Wellen
Die Beschreibung der Lundberg B Wellen ist in der Literatur sehr inhomogen, verschiedene Wellenformen werden unter diesem Begriff zusammengefasst (Martinez-Tejada, Arum, Wilhjelm, Juhler, Andresen, 201933). Beispielsweise wird berichtet, dass Lundberg B Wellen sowohl sinusförmige wie auch rampenförmige Formen aufweisen können, wobei die einzelnen Wellenberge mit einer Frequenz von 0,5 bis 3/min auftreten können.


Es wird beschrieben, dass diese Wellen ein Indikator für eine reduzierte Compliance sein können (Spiegelberg, Preuß, Kurtcuoglu, 201634). Es besteht jedoch bislang in der Literatur keine Einigkeit über den diagnostischen Wert der Lundberg B Wellen für die Diagnose des Hydrocephalus und für der Vorhersage, ob ein Patient von einem Shunt profitieren kann.
Die rampenförmigen Lundberg B Wellen scheinen in Verbindung mit erhöhten pCO2-Werten (d.h. einer erhöhten Konzentration von CO2 im arteriellen Blut) durch Schnarchen und Schlafapnoe aufzutreten (Spiegelberg, Preuß, Kurtcuoglu, 201635 und Román, Jackson, Fung, et al., 201936). Sinusförmige Lundberg B Wellen könnten dagegen mit Veränderungen des arteriellen Blutdrucks zusammenzuhängen, die nicht mit Veränderungen des Atemrhythmus oder des arteriellen CO2 assoziiert sind (Spiegelberg, Preuß, Kurtcuoglu 201637).
Zusammenfassend kann man sagen, dass im Kurvenverlauf von ICP-Messungen verschiedenen Morphologien auftreten können. Beispielsweise sind die pulsatilen und respiratorischen Anteile physiologisch, d.h. sie kommen auch bei Gesunden vor. Die Lundberg A-Wellen deuten hingegen klar auf pathologische Veränderungen hin, wegen der lebensbedrohlichen hohen ICP-Werte ist eine sofortige Therapie erforderlich.
Zusammenfassung
Literaturverzeichnis
Kapitel 1:
1: Lawrence Yu, Brian J Kim, Ellis Meng; Chronically implanted pressure sensors: challenges and state of the field; Sensors, 2014 Oct 31;14(11):20620-44.
2: Jiang G., Zhou D.D. (2009) Technology Advances and Challenges in Hermetic Packaging for Implantable Medical Devices. In: Zhou D., Greenbaum E. (eds) Implantable Neural Prostheses 2. Biological and Medical Physics, Biomedical Engineering. Springer, New York, NY
3: Schuhmann et al., Pediatr. Neurosurg., 2008, 44, 269-279
4, 5, 6: Holm et al., Medical Engineering & Physics 31 (2009) 601–606
------------------
Kapitel 2:
7: Carrera E, Kim DJ, Castellani G, et al. What shapes pulse amplitude of intracranial pressure?. J Neurotrauma. 2010;27(2):317-324. doi:10.1089/neu.2009.0951
8, 9, 10, 11: Le Roux P. Intracranial Pressure Monitoring and Management. In: Laskowitz D, Grant G, eds. Translational Research in Traumatic Brain Injury. Boca Raton (FL): CRC Press/Taylor and Francis Group; 2016.
12, 13,14, 15: Czosnyka M, Smielewski P, Timofeev I, et al. Intracranial pressure: more than a number. Neurosurg Focus. 2007;22(5):E10. Published 2007 May 15. doi:10.3171/foc.2007.22.5.11
16: Czosnyka M, Pickard JD. Monitoring and interpretation of intracranial pressure. J Neurol Neurosurg Psychiatry. 2004;75(6):813-821. doi:10.1136/jnnp.2003.033126
17: TeachMeSurgery, 2020: teachmesurgery.com/neurosurgery/flow-and-pressure/monro-kellie-doctrine/ abgerufen am 7. September 2020
18: Eide PK. The correlation between pulsatile intracranial pressure and indices of intracranial pressure-volume reserve capacity: results from ventricular infusion testing. J Neurosurg. 2016;125(6):1493-1503. doi:10.3171/2015.11.JNS151529.
19: Pennacchietti, Valentina et al. “Single center experiences with telemetric intracranial pressure measurements in patients with CSF circulation disturbances.” Acta Neurochirurgica (2020): 1 - 11.
20: Czosnyka M, Smielewski P, Timofeev I, et al. Intracranial pressure: more than a number. Neurosurg Focus. 2007;22(5):E10. Published 2007 May 15. doi:10.3171/foc.2007.22.5.11
21: Ratner, B. The correlation coefficient: Its values range between +1/−1, or do they?. J Target Meas Anal Mark 17, 139–142 (2009). doi.org/10.1057/jt.2009.5
22: Jin SC, Choi BS, Kim JS. The RAP Index during Intracranial Pressure Monitoring as a Clinical Guiding for Surgically Treated Aneurysmal Subarachnoid Hemorrhage: Consecutive Series of Single Surgeon. Acute Crit Care. 2019;34(1):71-78. doi:10.4266/acc.2019.00437
23: Czosnyka M, Smielewski P, Timofeev I, et al. Intracranial pressure: more than a number. Neurosurg Focus. 2007;22(5):E10. Published 2007 May 15. doi:10.3171/foc.2007.22.5.11
24: Czosnyka M, Steiner L, Balestreri M, et al. Concept of "true ICP" in monitoring and prognostication in head trauma. Acta Neurochir Suppl. 2005;95:341-344. doi:10.1007/3-211-32318-x_70
25: Varsos GV, Kasprowicz M, Smielewski P, Czosnyka M. Model-based indices describing cerebrovascular dynamics. Neurocrit Care. 2014;20(1):142-157. doi:10.1007/s12028-013-9868-4
26: Czosnyka M, Czosnyka Z. Origin of intracranial pressure pulse waveform. Acta Neurochir (Wien). 2020;162(8):1815-1817. doi:10.1007/s00701-020-04424-4
27: nursekey.com/intracranial-hypertension-theory-and-management-of-increased-intracranial-pressure/ abgerufen am 07. September 2020
28, 29: Czosnyka M, Czosnyka Z. Origin of intracranial pressure pulse waveform. Acta Neurochir (Wien). 2020;162(8):1815-1817. doi:10.1007/s00701-020-04424-4
30: d-nb.info/1001032489/34 abgerufen am 7. September 2020
31: Ian Peate, Karen Wild, Muralitharan Nair: Nursing practice: knowledge and care, edited, 2018, Wiley
32: Lundberg N. Continuous recording and control of ventricular fluid pressure in neurosurgical practice. Acta Psychiatr Scand Suppl. 1960;36(149):1-193.
33: Martinez-Tejada I, Arum A, Wilhjelm JE, Juhler M, Andresen M. B waves: a systematic review of terminology, characteristics, and analysis methods. Fluids Barriers CNS. 2019;16(1):33. Published 2019 Oct 15. doi:10.1186/s12987-019-0153-6
34, 35: Andreas Spiegelberg, Matthias Preuß, Vartan Kurtcuoglu,B-waves revisited, Interdisciplinary Neurosurgery, Volume 6, 2016, Pages 13-17, doi.org/10.1016/j.inat.2016.03.004.
36: Román, G.C., Jackson, R.E., Fung, S.H. et al. Sleep-Disordered Breathing and Idiopathic Normal-Pressure Hydrocephalus: Recent Pathophysiological Advances. Curr Neurol Neurosci Rep 19, 39 (2019). doi.org/10.1007/s11910-019-0952-9
37: Andreas Spiegelberg, Matthias Preuß, Vartan Kurtcuoglu,B-waves revisited, Interdisciplinary Neurosurgery, Volume 6, 2016, Pages 13-17, doi.org/10.1016/j.inat.2016.03.004.