LP-Shunt vs. VP-Shunt
Die lumboperitoneale Ableitung als Alternative
Vorwort
Seit der Entstehung der Hydrocephalus-Shunt-Therapie in den 1950er Jahren dominierte die Hirnwasser-Ableitung von den Hirn-Ventrikeln in den Bauchraum (VP-Shunt/VPS) mit einer Anwendungshäufigkeit von über 70%. Die alternative Ableitung aus dem Lumbalbereich (LP-Shunt/LPS) stand dagegen im Verdacht, komplikationsanfälliger zu sein. In den letzten beiden Jahrzehnten hat jedoch der Einsatz des LP-Shunting deutlich zugenommen.
mehr lesen
Geschichte der Shunt Therapie
Seit den 1950er Jahren ist die Implantation eines Shunt-Systems die Standard-Therapie zur Behandlung des Hydrocephalus. Der Shunt besteht aus einem Schlauch-Ventil-System, das überschüssiges Hirnwasser (auch: „Liquor“, „CSF“ = Cerebrospinal fluid) in eine andere Körperhöhle ableitet, wo es wieder aufgenommen werden kann. Gleichzeitig gab und gibt es immer wieder Versuche, alternative Behandlungsmöglichkeiten zu entwickeln, beispielsweise mittels Medikamenten oder durch spezielle operative Eingriffe, wie z.B. eine endoskopische Drittventrikulostomie (ETV) oder die teilweise oder vollständige Entfernung der Plexus Choroidei, den Strukturen im Gehirn, in denen Hirnwasser gebildet wird (1-5). Diese sind jedoch letztlich bis heute ohne größere Relevanz geblieben und konnten die Shunt-Therapie nicht ersetzen.
Die Implantation eines Shunts ist im Vergleich zu anderen neurochirurgischen Eingriffen im Allgemeinen weder gefährlich noch schwierig. Ein typisches Ableitungssystem (siehe unten) besteht mindestens aus Kathetern aus Silikon und einem Ventil, das den Hirninnendruck reguliert. Die Katheter, das Ventil und weitere optionale Komponenten werden subkutan, unter der Haut, implantiert. Die Katheter werden mit einem Tunnelierungs-Instrument unter der Haut entlanggeführt und das Ventil wird mit Hilfe eines kleinen Schnittes in einer Hauttasche fixiert. Nur die Spitzen (Öffnungen) des Zu- und des Ableitungskatheters dringen je nach Shunt-Typ invasiv in die jeweils erforderliche Körperhöhle ein.
ARTEN DER SHUNT-ABLEITUNG: VP, LP, VA
Zur Ableitung kommen theoretisch eine Vielzahl von Körperhöhlen in Betracht. Von diesen Ableitungsmöglichkeiten haben aber nur noch drei eine praktische Bedeutung. Alle anderen Ableitungsarten werden lediglich in seltenen Spezialfällen eingesetzt.
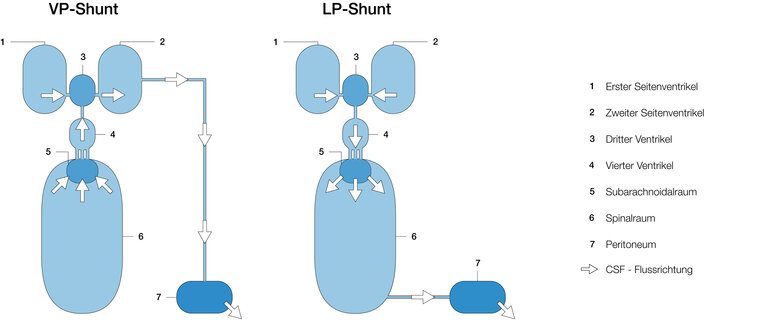
1. Ventrikuloperitoneal (VP): aus den Hirnventrikeln (Kopf) in das Peritoneum (Bauchhöhle)
2. Lumboperitoneal (LP): aus dem Wirbelsäulenkanal in das Peritoneum
3. Ventrikuloatrial (VA): von den Hirnventrikeln (Kopf) in das rechte Atrium des Herzens
Diese drei Ableitungsarten werden seit den 1960er Jahren eingesetzt und sind operativ gut erprobt. Wie in Abbildung 1 gezeigt, werden die Ventile und weitere optionale Komponenten unter anderem retroaurikulär (d.h. hinter dem Ohr), im Thorax- oder im Lumbal-Bereich platziert.

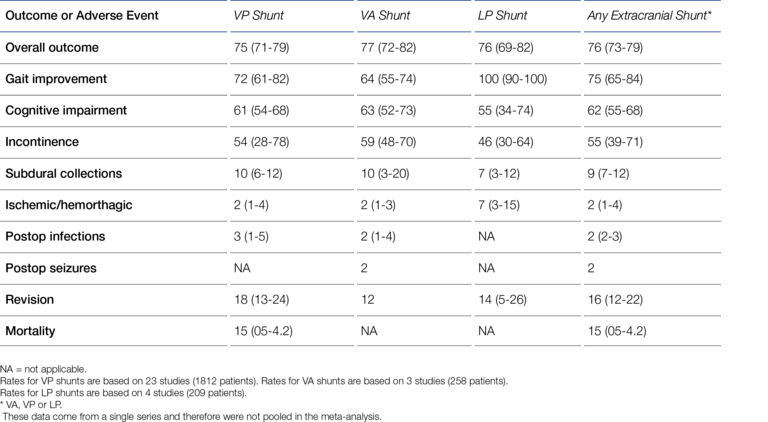
Für die Anlage des Ventrikelkatheters muss ein Bohrloch durch die Schädelkalotte (Schädelknochen) angelegt werden, um einen Zugang zum Ventrikelsystem zu schaffen. Trotz dieser offensichtlichen Invasivität hat sich die VP-Ableitung schon früh gegen die LP- und VA-Ableitung als Standardmethode durchgesetzt. Laut Aschoff waren im Jahr 1999 98% der pädiatrischen Shunt-Anlagen und mehr als 80% der Shunt-Anlagen bei Erwachsenen VP-Shunt-Anlagen (6). Giordan et al. haben jüngst (2018) eine systematische Metaanalyse von 2.461 iNPH-Shunt-Patient*innen (iNPH = Idiopathic Normal Pressure Hydrocephalus) veröffentlicht, die die gleiche Tendenz zeigt wie Aschoffs Angaben (7):
- VP-shunt: 1812 patients (74%)
- LP-shunt: 209 patients (8.5%)
- VA-shunt: 258 patients (10.5%)
- ETV: 182 patients (7.4%) (ETV = Endoscopic Third-Ventriculostomy)
Traditionell wurde die LP-Ableitung immer dann verwendet, wenn der Zugang zu den Ventrikeln erschwert war, d.h. insbesondere bei Patient*innen mit engen Ventrikeln bzw. Schlitzventrikeln. Die proximalen Katheter - vorwiegend Ventrikelkatheter (VK) und Lumbal-Katheter (LK) - sind häufig geschlossene Katheter, deren Spitzen kleine Drainagelöcher enthalten, durch die CSF eintreten kann. Ebenso sind aber auch am Ende offene Katheter gebräuchlich. Es gibt deutliche Hinweise, dass eine Fehlplatzierung des Ventrikelkatheters die Komplikationsrate für den Shunt signifikant erhöht, insbesondere, weil die CSF-Eintrittslöcher von zu enganliegendem Hirngewebe verstopft werden (8-10). Deshalb spielt der LP-Shunt für die Versorgung von IIH-Patient*innen (IIH = Idiopathic Intracranial Hypertension, früher PTC = Pseudo-Tumor Cerebri bzw. BIH, Benign Intracranial Hypertension), die enge Ventrikel aufweisen, eine besonders wichtige Rolle (11). Azad et al. haben jüngst (2020) ein typisches Beispiel publiziert, bei dem von 1.082 IIH-Patient*innen sogar 32% einen LP-Shunt erhielten (12).
Die LP-Ableitung ist allerdings ausschließlich bei „Hydrocephalus communicans“ (kommunizierendem Hydrocephalus) indiziert, d.h. bei Hydrocephalus-Formen, die nicht durch die Blockade eines CSF-Flussweges entstehen (13). Ist beispielsweise das Aquädukt zwischen dem dritten und vierten Ventrikel bzw. Spinalraum blockiert, wäre eine lumboperitoneale Ableitung nicht nur therapeutisch wirkungslos, sondern sogar kontraindiziert, da der entstehende Druckgradient zwischen oberer Hirnhälfte und dem Spinalraum eine gefährliche Verschiebung und Einklemmung von Hirnteilen („Tonsilar Herniation“) begünstigen würde (14-16). Dieser Druckgradient entsteht deshalb, weil sich im oberen Hirnteil die Ventrikel befinden und dort ein Hauptteil der CSF-Produktion stattfindet.
Vorteile des LP-Shunts
Der LP-Shunt hat auf den ersten Blick einige Vorteile. Auch wenn diese Ableitungsvariante selten praktiziert wird, kann sie mit Lokal-Anästhesie durchgeführt werden, wenn dies Vorteile für Patient*innen bietet. Besonders attraktiv erscheint auch, dass der Schädelknochen nicht wie beim VP-Shunt durchbohrt werden muss und deshalb bei der Shunt-Anlage keine Gefahr einer Hirnverletzung oder gar Gehirn-Blutung besteht (17). Insgesamt kann man die LP-Shunt-Anlage im Vergleich zur VP-Shunt-Anlage als weniger invasiv betrachten. Über geraume Zeit stand der LP-Shunt jedoch generell „unter Verdacht“ mit unakzeptabel hohen Komplikationsraten im Vergleich zum VP-Shunt einherzugehen (18-20). Im letzten Jahrzehnt vorgelegte, größere, auch randomisierte Studien und Metareviews haben diesen Verdacht jedoch zerstreuen können (21-23). Ein gutes aktuelles Beispiel hierfür liefert hier das Meta-Review von Giordan et al., die auf Basis umfangreicher Daten von mehr als 2.000 Patient*innen (mindestens) die Gleichwertigkeit von LP- und VP-Shunt bezüglich Sicherheit und Leistung, d.h. bezüglich Komplikationsraten und therapeutischem Erfolg („Outcome“), nachweisen (siehe Abbildung 2) (7).
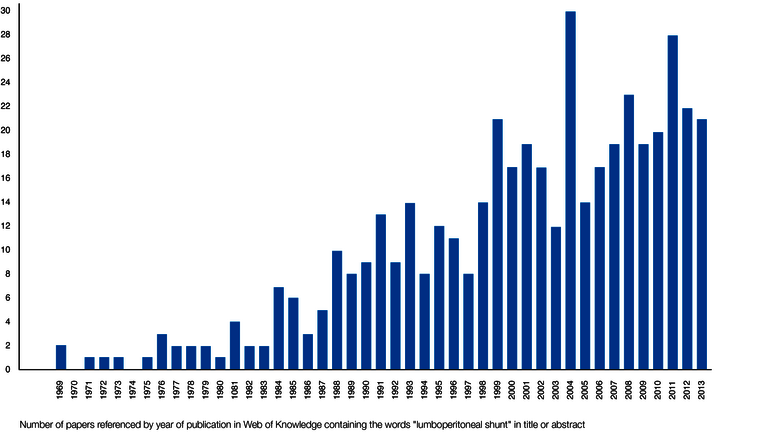
Solche positiven Befunde haben besonders im asiatischen Raum wie z.B. in Japan, aber auch weltweit zu einem Anwachsen der Quote von LP-Shunts geführt. Bereits 2011 wurden in Japan mehr iNPH-Patient*innen mit einem LP-Shunt versorgt, als mit einem VP-Shunt (21; 24). Abbildung 3 reflektiert die weltweit zunehmende Anwendung der LP-Ableitung anhand einer Literatursuche nach dem Stichwort „Lumboperitoneal shunt“ im interdisziplinären „Web of science“ (25).
Spezifische Komplikationen des LP-Shunts
Die möglichen Komplikationen und ihre Ursachen überschneiden sich nur zum Teil zwischen VP- und LP-Shunt. Neben Gemeinsamkeiten, wie vor allem mechanischen Ventil-Problemen, geht jeder Shunt-Typ auch mit spezifischen Komplikationen einher. Jusue-Torres et al. haben aus 602 LP-Shunt-Studien zwischen 1971 und 2013 anhand von 2.871 behandelten Patient*innen die unterschiedlichen LP-Komplikationsgründe analysiert (25). Das (auf die wesentlichen Faktoren reduzierte) Ergebnis ist in folgender Abbildung 4 zu sehen. Die Prozentangaben beziehen sich dabei auf die kumulierte Gesamtzahl aller Komplikationen.
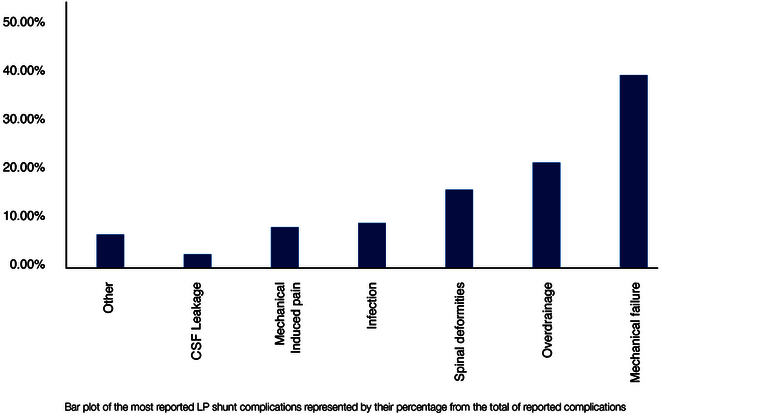
Aufgrund der Implantation in dem besonders beweglichen und viel bewegten lumbalen Bereich des Körpers dominieren beim LP-Shunt mechanische Komplikationen. Zu diesen zählen Katheter-Abrisse, Ventil-Brüche, Katheter-Migration und Fehlplatzierungen, aber ebenso die auch beim VP-Shunt häufigen Obstruktionen (26). In Übereinstimmung mit anderen Arbeiten stellt auch (ebenfalls wie beim VP-Shunt) die Überdrainage eine der häufigsten Komplikation dar (25,27,28).
Folgende Komplikationen sind dagegen spezifisch für den LP-Shunt und beim VP-Shunt sehr selten oder sogar ausgeschlossen (s.h. Abb. 4):
- „Spinal Deformities (Wirbelsäulenverformungen) (16%)“
- „Mechanical-Induced Pain (Mechanisch-induzierte Schmerzen) (8 %)“
- „CSF Leakage (Hirnwasser-Leckage) (3 %)“ und
- „Others (Andere) (5,5%)“.
Die erste Gruppe, die „spinalen Deformationen“, beinhaltet im Wesentlichen Wachstumsstörungen der Wirbelsäule, die durch einen LP-Shunt ausgelöst werden können, soweit er bereits in sehr jungem Alter, beispielsweise bei Kindern, implantiert wurde. Die zweite Gruppe umfasst verschiedene Rückenschmerzen (z.B. „Radikulopathie“), die durch eine Reizung von Spinalnerven zustande kommen können. Der LP-Shunt muss in solchen Fällen revidiert werden. Die dritte Gruppe, das CSF-Leck, kann durch eine Undichtigkeit der spinalen Dura (der „harten Hirnhaut“, die auch den Spinalkanal umschließt) entstehen, da die für die lumbale Punktion genutzte Tuohy-Kanüle einen etwas größeren Durchmesser als der letztlich angelegte LP-Katheter haben muss. Die Gruppe „Others“ wird mit 5.5% von der bereits erwähnten „Tonsilar Herniation“, d.h. dem Verrutschen und Einklemmen von Hirnteilen dominiert, das ausschließlich bei der LP-Ableitung beobachtet wurde. Die Ursache hierfür liegt in hydrostatischen und hydrodynamischen Prozessen, die im Folgenden besprochen werden.

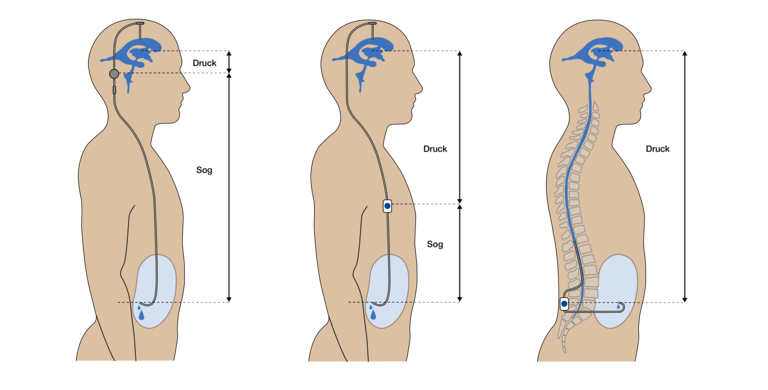
An dieser Stelle muss auf ein häufiges und relevantes Missverständnis eingegangen werden, das vermutlich aus ungenauen Formulierungen in der Literatur herrührt. Neben dem Problem einer suboptimalen Ventileinstellung, wird bekanntermaßen im üblichen Sprachgebrauch die Über- und Unterdrainage hauptsächlich durch den sogenannten „Siphoneffekt im Stehen“ ausgelöst. In aufrechter Position liegen die Ventrikel 30-60cm über dem Ableitungsort, so dass die im Katheter hängende Hirnwassersäule durch ihr nach unten ziehendes Eigengewicht („Gravitation“) in den Ventrikeln einen starken Sog erzeugt. Hierzu schreiben beispielsweise Ho et al. 2023 (22):
“Although rare, over drainage causing slit ventricle syndrome, intracranial hypotension syndrome, chronic subdural effusion, or subdural hemorrhage may also be the disadvantages of VPS.
On the other hand, the lumbar exit and peritoneal entry for LPS are generally at the same level when the patients are upright to minimize the effect of gravity, and the siphoning effect is negligible.”
Im selben Sinne schreibt Miyake (26):
“All valves except valves with a membrane-type antisiphon mechanism can be implanted in any location in LP shunts.
Use of valves with membrane-type antisiphon mechanisms is unnecessary because the siphon effect is negligible in LP shunts.”
Die Aussage, der Siphon-Effekt sei zu vernachlässigen, wenn der Zuleitungsort (lumbal) und der Ableitungsort (peritoneal) in stehender Position auf der gleichen Höhe (Level) liegen, ist formal zutreffend, erscheint aber irreführend. Es entsteht hier der Eindruck, die hydrostatischen Druckverhältnisse in stehender Position seien für den LP-Shunt irrelevant und es seien keine Gegenmaßnahme (wie beim VP-Shunt) erforderlich. Im Fall der LP-Ableitung ist zwar tatsächlich UNTER dem Ventil keine „hängende Flüssigkeitssäule“ mehr vorhanden, dafür aber ÜBER dem Ventil das ganze Gewicht der Flüssigkeitssäule. Diese Aussage kann verwirren, da nach oben kein flüssigkeitsgefüllter Katheter (wie beim VP-Shunt) vorhanden ist. Jedoch herrscht auch im (flüssigkeitsgefüllten) Spinalkanal derselbe hydrostatische Druck, der proportional zum Abstand von den Ventrikeln nach unten hin zunimmt („p = r*g*h“). Für das Ventil, das immer ein Differenzdruckventil ist, spielt aber ausschließlich die Differenz der Drücke am Einlass und am Auslass die entscheidende Rolle. Somit ist es egal, ob das Ventil im Stehen durch einen starken zusätzlichen Sog am Auslass („Siphoning“) oder einen erhöhten Druck am Einlass geöffnet wird. Deshalb ist folgende Formulierung von Mirone et al. angemessener (29):
“Lumboperitoneal shunts may produce similar posture-related problems. The difference is that the hydrostatic pressure does not produce pulling but rather pushing force in the vertical body position.“
Fakt bleibt, dass sowohl beim VP- als auch beim LP-Shunt ein zusätzlicher, starker Differenzdruck in Rechnung gestellt werden muss, der nur in aufrechter Position auftritt. Dieser öffnet das Ventil unvermeidlich und kann dadurch zur Überdrainage führen. Die hydrostatischen Druckverhältnisse sind in Abbildung 5 dargestellt.
Verschiedene Autoren haben gezeigt, dass deshalb auch beim LP-Shunt die Implantation eines Anti-Siphon-Devices (ASD) notwendig und wirksam ist. Eingesetzt wurden dabei verschiedene Gravitationsventile und der sogenannte SiphonGuard (23,28,30). Der SiphonGuard unterbindet in stehender Position die (Über)Drainage zwar nicht vollständig, reduziert aber den Fluss und verlangsamt somit ihre Entstehung. Daneben wurde auch der Einsatz von Flussdrosseln in Form von schmallumigen Kathetern (Innendurchmesser 0.8 mm) für die Vermeidung der Überdrainage beschrieben. Diese reduzieren den Fluss im LP-Shunt generell, d.h. unabhängig von der Körperlage. Eine aktuelle, vergleichende Studie von Nakajima mit 115 eingeschlossenen iNPH Patient*innen legt hier allerdings eine Überlegenheit von Gravitationsventilen nahe (30). Einen Spezialfall stellen die von Miyake erwähnten Membran-basierten ASDs dar (Delta® Chamber & ASD), da diese unterschiedlich stark auf den Druck am Einlass bzw. den Sog am Auslass reagieren. Ihre Funktion hängt vom passenden Verhältnis Eingangsdruck/Ausgangssog, und damit essentiell von der angemessenen Implantationshöhe im Körper ab. Deshalb sind solche Membranventile für LP-Shunts tatsächlich als problematisch zu betrachten (26).
Abbildung 6 zeigt einen schematischen Vergleich der dynamischen Verhältnisse innerhalb des VP- und LP-Shunts. Im VP-Shunt wird der Liquor direkt aus den Ventrikeln in den Bauchraum drainiert. Bilden sich bei einer Überdrainage Schlitzventrikel, so ist der dann von Gewebe eingeklemmte Ventrikelkatheter besonders durch Okklusion gefährdet. Durch die andere Art der Ableitung ist dies beim LP-Shunt nicht möglich. Hier fließt der überschüssige Liquor zunächst durch den IV. Ventrikel in den Subarachnoidal- und dann in den Spinalraum, bevor er von dort in den Bauchraum drainiert wird. Eine Verstopfung des Lumbalkatheters durch Gewebe-Einquetschung ist hier unwahrscheinlicher. Aber die Flussbewegung von den oberen drei Ventrikeln durch den IV. Ventrikel in den Spinalkanal birgt die Gefahr der Mitführung/Mitbewegung bestimmter Hirnteile, was zur ebenso gefährlichen Herniation führen kann (sh. Flussrichtung LP-Shunt Abb. 6). Ganz deutlich wird dieser Zusammenhang bei nicht-kommunizierendem Hydrocephalus, insbesondere durch ein okkludiertes Aquädukt. Der in den oberen drei Ventrikeln herrschende Überdruck würde das gesamte Gehirn in Richtung Spinalkanal bewegen, sobald der Spinalkanal geöffnet würde. Aus diesem Grund ist der nicht-kommunizierende Hydrocephalus auch eine wichtige Kontraindikation für den LP Shunt (13).
Ventiltypen für den LP Shunt
Wie beschrieben unterscheiden sich die für einen LP-Shunt einsetzbaren Differenzdruckventile in ihrer technischen Funktion nicht von denen für einen VP-Shunt. In der Literatur sind keine besonderen technischen Anforderungen an LP-Ventile beschrieben und im Prinzip lässt sich jedes beliebige Differenzdruckventil hierfür einsetzen.
Aus dem Implantationsort im besonders dynamischen lumbalen Körperbereich ergeben sich allerdings einige besondere Anforderungen an die mechanische Stabilität eines LP-Ventils, insbesondere an seine subkutane Fixierbarkeit. Das Ventil eines VP-Shunts, das unter dünner unbeweglicher Kopfhaut auf festem Schädelknochen implantiert ist, ist im Vergleich zum Ventil eines LP-Shunts deutlich geringeren mechanischen Belastungen ausgesetzt. Beim LP-Shunt ist es essentiell, eine mögliche Migration des Ventils und damit Katheter-Abrisse durch Fixierung im Gewebe zu verhindern. Ebenfalls wichtig ist hier die mechanische Bruchfestigkeit des Ventilkörpers wegen möglicher Verbiegung. Für Gravitationsventile muss zusätzlich eine Änderung des Neigungswinkels (Verdrehung) ausgeschlossen werden, da sie exakt an der Körperachse ausgerichtet sein müssen. Daher sind Fixationsösen am Ventil vorteilhaft, die sich am subkutanen Gewebe festnähen lassen. Mirone et al. nennen hier z.B. das Integra™ Horizontal-Vertical (H-V) Lumbar Valve und das MIETHKE DUAL SWITCH Valve (DSV) als geeignete Ventile (29). Für Verstellventile, die heutzutage überwiegend zum Einsatz kommen, ist außerdem eine zu große Implantationstiefe zu vermeiden, um die magnetische Verstellfunktion nicht zu beinträchtigen. Zusätzlich sollte für die Möglichkeit einer notwendigen Verstellung eine feste Unterlage bzw. ein festes Widerlager gegeben sein, was sich beispielsweise durch die Implantation auf der Faszie oder dem Rippenbogen bewerkstelligen lässt. Ebenso zielführend können hierfür Ventile mit möglichst breiter Basisfläche oder eine implantierbare breitflächige Ventil-Haltevorrichtung eingesetzt werden. Damit lässt sich beim Verstellvorgang einem "Versinken" der Ventile im Körper weitestestgehend entgegenwirken. Miyake hat nach diesen Kriterien die Eignung einiger weit verbreiteter Verstellventile als LP-Shunt eingeschätzt. Das Ergebnis ist in Abbildung 7 zu sehen (26).
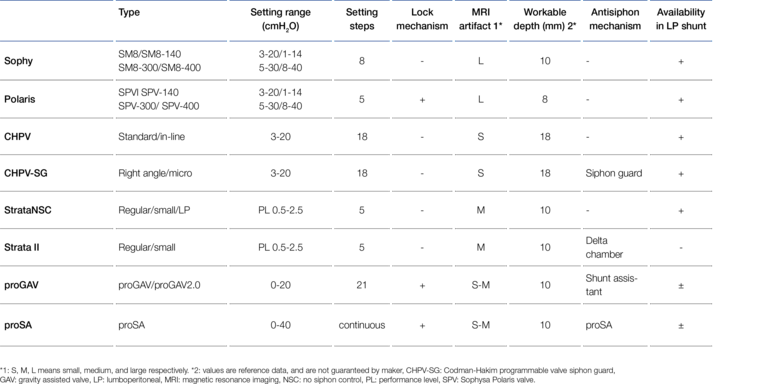
Das MIETHKE proGAV® und das proSA®Ventil waren nach Miyakes Einschätzung von 2016 nur bedingt in LP-Shunts einsetzbar, weil sie sich nicht direkt subkutan fixieren ließen. Seit 2023 ist dies jedoch mit dem sogenannten „Ventilboard“, einem implantierbaren Widerlager aus biokompatiblem Silikon, möglich.

Literatur
1. Crea A, Bianco A, Cossandi C, Forgnone S, Fornaro R, Crobeddu E, Marino D, Piras G, Scalia G, Saglietti C, Boldorini R, Galzio R, Panzarasa G. Choroid Plexus Carcinoma in Adults: Literature Review and First Report of a Location into the Third Ventricle. World Neurosurgery. 2020 Jan; 133:302-307. doi: 10.1016/j.wneu.2019.10.051.
2. Desai B, Hsu Y, Schneller B, Hobbs JG, Mehta AI, Linninger A. Hydrocephalus: the role of cerebral aquaporin-4 channels and computational modeling considerations of cerebrospinal fluid. Neurosurg Focus. 2016 Sep; 41(3): E8. doi: 10.3171/2016.7.FOCUS16191
3. Mazzola CA, Choudhri AF, Auguste KI, Limbrick DD, Jr., Rogido M, Mitchell L, Flannery AM, Pediatric Hydrocephalus Systematic R. and Evidence-Based Guidelines Task F. Pediatric hydrocephalus: systematic literature review and evidence-based guidelines. Part 2: Management of posthemorrhagic hydrocephalus in premature infants. J Neurosurg Pediatr. 2014 Nov; 14(1): 8-23. doi: 10.3171/2014.7.PEDS14322
4. Zhu X, Di Rocco C. Choroid plexus coagulation for hydrocephalus not due to CSF overproduction: a review. Childs Nerv Syst. 2013 Jan; 29(1): 35-42. doi: 10.1007/s00381-012-1960-0
5. Cartwright CC and Wallace DC. Nursing care of the pediatric neurosurgery patient. Springer-Verlag; 2007. Available from: doi: 10.1007/978-3-642-32554-0
6. Aschoff A, Kremer P, Hashemi B, Kunze S. The scientific history of hydrocephalus and its treatment. Neurosurg Review. 1999 Oct; 22(2-3): 67-93; discussion 94-65. doi: 10.1007/s101430050035
7. Giordan E, Palandri G, Lanzino G, Murad MH, Elder BD. Outcomes and complications of different surgical treatments for idiopathic normal pressure hydrocephalus: a systematic review and meta-analysis. Journal of Neurosurgery. 2018 Nov 1; 1-13. doi: 10.3171/2018.5.JNS1875
8. Hayhurst C, Beems T, Jenkinson MD, Byrne P, Clark S, Kandasamy J, Goodden J, Nandoe Tewarie RD, Mallucci CL. Effect of electromagnetic-navigated shunt placement on failure rates: a prospective multicenter study. Journal of Neurosurgery. 2010 Dec; 113(6): 1273-1278. doi: 10.3171/2010.3.JNS091237
9. Janson CG, Romanova LG, Rudser KD and Haines SJ. Improvement in clinical outcomes following optimal targeting of brain ventricular catheters with intraoperative imaging: Clinical article. Journal of Neurosurgery. 2014 Mar; 120(3): 684-696. doi: 10.3171/2013.8.JNS13250
10. Tuli S, O'Hayon B, Drake J, Clarke M, Kestle J. Change in ventricular size and effect of ventricular catheter placement in pediatric patients with shunted hydrocephalus. Neurosurgery. 1999 Dec; 45(6): 1329-1333; discussion 1333-1325. doi: 10.1097/00006123-199912000-00012
11. Abubaker K, Ali Z, Raza K, Bolger C, Rawluk D, O'Brien D. Idiopathic intracranial hypertension: lumboperitoneal shunts versus ventriculoperitoneal shunts--case series and literature review. British Journal of Neurosurgery. 2011 Feb; 25(1): 94-99. doi: 10.3109/02688697.2010.544781
12. Azad TD, Zhang Y, Varshneya K, Veeravagu A, Ratliff JK, Li G. Lumboperitoneal and Ventriculoperitoneal Shunting for Idiopathic Intracranial Hypertension Demonstrate Comparable Failure and Complication Rates. Neurosurgery. 2020 Feb; 86(2): 272-280. doi: 10.1093/neuros/nyz080
13. Yadav Y. R., Parihar V, Sinha M. Lumbar peritoneal shunt. Neurol India. 2010;58(2): 179-184. DOI: 10.4103/0028-3886.63778
14. Marupudi NI, Harris C, Pavri T, Mell B, Singh R, Ham SD and Sood S. The role of Lumboperitoneal shunts in managing chronic hydrocephalus with slit ventricles. Journal of Neurosurgery Pediatrics. 2018 Dec 1; 22(6): 632-637. doi: 10.3171/2018.6.PEDS17642
15. Cheng CH, Lin HL, Chuang HY. Tonsillar herniation as a complication of Lumboperitoneal shunt: case report and literature review. British Journal of Neurosurgery. 2018 Dec 6; 1-4. doi: 10.1080/02688697.2018.1538481
16. Beeravolu L, Ahmed I. Complications from management of idiopathic intracranial hypertension: A case of CSF overdrainage from a Lumboperitoneal shunt. Cephalalgia. 2016; 36: 108
17 . Miyajima M, Kazui H, Mori E, Ishikawa M, Sinphoni-Investigators o. b. o. t. One-year outcome in patients with idiopathic normal-pressure hydrocephalus: comparison of Lumboperitoneal shunt to ventriculoperitoneal shunt. Journal of Neurosurgery. 2016 Dec; 125(6): 1483-1492. doi: 10.3171/2015.10.JNS151894
18. Kandasamy J, Hayhurst C, Clark S, Jenkinson MD, Byrne P, Karabatsou K, Mallucci CL. Electromagnetic stereotactic ventriculoperitoneal csf shunting for idiopathic intracranial hypertension: a successful step forward? World Neurosurgery. 2011 Jan 7; 75(1): 155-160; discussion 132-153. doi: 10.1016/j.wneu.2010.10.025
19. Karabatsou K, Quigley G, Buxton N, Foy P, Mallucci C. Lumboperitoneal shunts: are the complications acceptable? Acta neurochirurgica (Wien). 2004 Nov; 146(11): 1193-1197. doi: 10.1007/s00701-004-0392-3
20. Menger RP, Connor DE Jr., Thakur JD, Sonig A, Smith E, Guthikonda B, Nanda A. A comparison of Lumboperitoneal and ventriculoperitoneal shunting for idiopathic intracranial hypertension: an analysis of economic impact and complications using the Nationwide Inpatient Sample. Neurosurgical Focus. 2014 Nov; 37(5): E4. doi: 10.3171/2014.8.FOCUS14436
21. Kazui H, Miyajima M, Mori E, Ishikawa M and Investigators S. Lumboperitoneal shunt surgery for idiopathic normal pressure hydrocephalus (SINPHONI-2): an open-label randomised trial. The Lancet Neurology. 2015 Jun; 14(6): 585-594. doi: 10.1016/S1474-4422(15)00046-0
22. Ho YJ, Chiang WC, Huang HY, Lin SZ and Tsai ST. Effectiveness and safety of ventriculoperitoneal shunt versus lumboperitoneal shunt for communicating hydrocephalus: A systematic review and meta-analysis with trial sequential analysis. CNS neuroscience & therapeutics. 2023 Jan 17; 29(3), 804–815. doi: 10.1111/cns.14086
23. Bloch O, McDermott MW. Lumboperitoneal shunts for the treatment of normal pressure hydrocephalus. Journal of the Neurosurgical Society of Australasia. 2012 Aug; 19(8): 1107-1111. doi: 10.1016/j.jocn.2011.11.019
24. Nakajima M, Miyajima M, Ogino I, Akiba C, Kawamura K, Kurosawa M, Kuriyama N, Watanabe Y, Fukushima W, Mori E, Kato T, Sugano H, Karagiozov K and Arai H. Shunt intervention for possible idiopathic normal pressure hydrocephalus improves patient outcomes: A nationwide hospital-based survey in Japan. Frontiers in Neurology. 2018 Jun; 9(421). doi: 10.3389/fneur.2018.00421
25. Jusue-Torres I, Hoffberger J, Rigamonti D. Chapter 14: Complications specific to Lumboperitoneal Shunt, in Complications of CSF Shunting in Hydrocephalus: Prevention, Identification and Management, p. edited by C. Di Rocco, M. Turgut, G. Jallo and J. F. Martinez Lage, Publisher: Springer, Heidelberg, London, New York, 2015,
26. Miyake H. Shunt Devices for the Treatment of Adult Hydrocephalus: Recent Progress and Characteristics. Neurologia medico-chirurgica (Tokyo). 2016 May 15; 56(5): 274-283. doi: 10.2176/nmc.ra.2015-0282
27. Marupudi NI, Pavri T, Harris C, Haridas A, Ham S, Sood S. Lumbar-Peritoneal Shunting in Hydrocephalus: Preventing Chiari Malformations and Decreasing Shunt Revisions. Journal of Neurosurgery. 2014 Apr; 124(4)
28. Kanazawa R, Ishihara S, Sato S, Teramoto A, Kuniyoshi N. Familiarization with lumboperitoneal shunt using some technical resources. World Neurosurgery. 2011 Sep-Oct; 76(3-4): 347-351. doi: 10.1016/j.wneu.2011.02.024
29. Mirone G, Spina D, Sainte-Rose C. Shunt hardware, in Pediatric Hydrocephalus. p. edited by G. Cinalli, Springer; 2019.
30. Nakajima M, Miyajima M, Akiba C, Ogino I, Kawamura K, Sugano H, Hara T, Tange Y, Fusegi K, Karagiozov K, Arai H. Lumboperitoneal Shunts for the Treatment of Idiopathic Normal Pressure Hydrocephalus: A Comparison of Small-Lumen Abdominal Catheters to Gravitational Add-On Valves in a Single Center. Operative neurosurgery (Hagerstown, Md.). 2018 Dec 1; 15(6): 634-642. doi: 10.1093/ons/opy044